화이자 2가 백신, 임상시험 없이 승인됐다? 이미 허가된 개량 백신 임상시험 결과에 기반해 개발
문제의 주장은 2022년 9월 3일 네이버 블로그에 게시됐다.
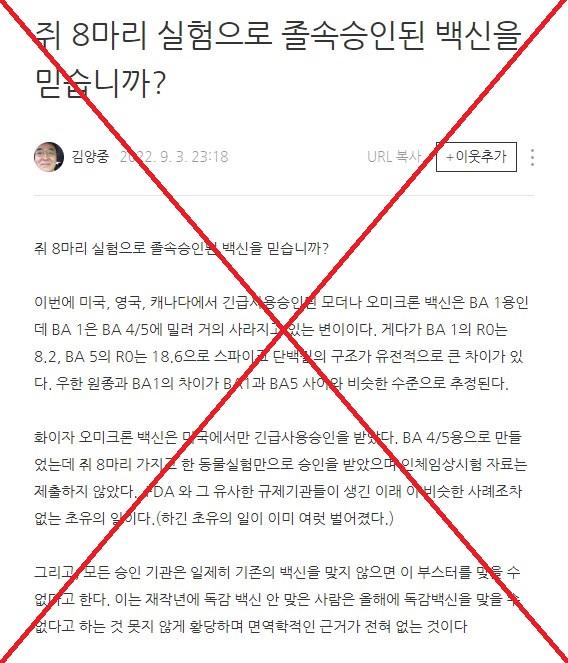
다음은 해당 주장에서 발췌한 내용이다.
"쥐 8마리 실험으로 졸속승인된 백신을 믿습니까?
"화이자 오미크론 백신은 미국에서만 긴급사용승인을 받았다. BA 4/5용으로 만들었는데 쥐 8마리 가지고 한 동물실험만으로 승인을 받았으며 인체임상시험 자료는 제출하지 않았다. FDA 와 그 유사한 규제기관들이 생긴 이래 이 비슷한 사례조차 없는 초유의 일이다.(하긴 초유의 일이 이미 여럿 벌어졌다.)"
유사한 주장이 네이버 블로그 여기, 여기에도 공유됐다.
하지만 이는 오해의 소지가 있는 주장이다.
화이자 측은 최초로 개발한 코로나19 백신을 기반으로 BA.1 변이를 대상으로 한 백신을 개발했다.
이 백신은 추후 또다시 BA.4 변이 및 BA.5 변이를 대상으로 한 '코미나티2주 01.mg/mL'로 개발됐다. 코미나티2주 01.mg/mL 개발에는 BA.1 백신에 사용된 임상시험 결과가 이용됐다.
화이자는 코미나티2주 01.mg/mL 개발 시 위에 언급한 총 세종의 백신을 각각 8마리의 쥐로 이루어진 세 그룹에 접종했다.
이 실험에서 코미나티2주 01.mg/mL가 가장 효과적인 면역반응을 보인 것으로 나타났다.
유럽 의약품청(The European Medicines Agency·EMA)의 마르코 카발레리(Marco Cavaleri) 백신 전략부서장은 BA.1 변이를 대상으로 한 백신에 사용된 임상시험 결과가 코미나티2주 01.mg/mL를 개발하는 데 있어 중요한 역할을 했다고 말한다.
그는 2022년 9월 20일 기자회견에서 BA.1 변이를 대상으로 한 백신과 코미나티2주 01.mg/mL는 기본적으로 "같은 요소로 구성돼 있다"며 "두 백신의 차이점은 백신에 포함된 mRNA가 각기 다른 변이 바이스에 맞게 설계됐다는 점이지만 이마저도 거의 유사하다"라고 말했다.
그는 이에 더해 전 단계 백신에서 얻은 자료를 새 백신 개발에 사용하는 것은 과학계에서 높이 평가되는 방법이며 면역학계에서도 널리 인정되는 방법이라고 설명했다.
프랑스 네커-엔펀츠 말라데스 연구소(Necker-Enfants Malades Institute)의 클로드 아그네스 레이노(Claude-Agnès Reynaud) 연구소장은 AFP 측에 전 단계 백신에서 얻은 자료를 새 백신 개발에 사용하는 것은 타당하며 시간을 절약할 수 있는 방법이라고 말했다.
그는 "mRNA 백신의 목적은 바이러스의 변이에 잘 대처할 수 있도록 하는 것이다. 임상시험을 진행할 경우 결과를 받아들기까지 6개월가량이 걸리는데 결과가 나오길 기다리면 그사이 또 다른 변이가 나타날 수도 있다"라고 말했다.
화이자 대변인 역시 AFP 측에 "[위와 같은] 이 개발 방법을 통해 현재 유행하는 변이 바이러스는 물론 앞으로 나타날 변이 바이러스에 효과적으로 대처할 수 있다"라고 밝혔다.
화이자의 코미나티2주 01.mg/mL는 2022년 9월 12일 EMA 측의 승인을 받았다.
EMA는 해당 백신이 "코로나19 초기 바이러스와 변이 바이러스(오미크론주 BA.4와 BA.5 공통부분) 각각의 항원을 발현하는 mRNA를 주성분으로 하는 백신”이라며 “기존 BA.1 개량백신과 코미나티2주 01.mg/mL의 기본 구성은 같다"라고 말했다.
하지만 이 백신이 미국에서 승인 받을 당시 몇몇 전문가들은 해당 백신이 직접적인 임상시험을 거치지 않았으므로 새로운 변이를 대상으로 얼마나 효과적일지 의문이라는 의견을 내비치기도 했다.
제네바 대학교의 앙투안 플라호(Antoine Flahault) 지구 보건 연구소 소장은 "관련 기관들이 [화이자 측에] 임상시험을 실시할 것을 요구할 수도 있었다"라며 "그럴 가능성은 적지만 새 백신이 변이 바이러스에 덜 효과적일 수도 있는 위험성을 안고서라도 백신 승인 절차를 빠르게 하는 것에 더 관심이 있었던 것으로 보인다"라고 말했다.
독감 백신 개발
플라호 소장은 코미나티2주 01.mg/mL 개발이 독감 백신 개발과 유사한 방식으로 이루어졌다고 설명한다.
그는 "독감 백신의 구성 성분은 매해 다르다. 독감 변이 바이러스는 각 시즌에만 유행하기 때문에 백신 제조 업체들이 임상시험을 실시하거나 새 백신의 효과에 테스트할 시간이나 자원이 충분하지 않다"라고 말했다.
독감 백신은 매년 변이 바이러스를 대상으로 기존 백신을 개량하는 방식으로 개발된다.
세계보건기구(WHO)는 매해 두 번의 회견을 열고 다음 해 유행할 독감 바이러스에 대응 가능한 백신의 성분 구성에 대해 제안하고 있다.
저작권 © AFP 2017-2026. 구독 없이 저작물을 영리적인 목적으로 사용하는 것을 금합니다. 자세한 정보는 여기서 확인하실 수 있습니다.
팩트체크 신청하기
문의



